Basado en el artículo original de Gregory Morin, Ph.D.
Basado en el artículo original de Gregory Morin, Ph.D.
Research Director, Seachem Laboratories, Inc.
Traducido y adaptado libremente por Aquanovel.com
El acuario es un sistema acuático cerrado donde la autorregulación existe únicamente en el mejor de los casos y existe un alto riesgo a que pueda destruirse si no es mantenido adecuadamente. Este mantenimiento implica adquirir con la experiencia una compresión básica de los procesos químicos que se producen en él. Por ello, cuanto mayor sea este conocimiento mayor será la capacidad de evitar o prevenir un posible desastre.
En este artículo vamos a tratar de acercar de forma sencilla y simplificando al máximo los principios químicos que rigen cualquier instalación de este tipo. Para comprenderlo en su totalidad haremos un breve repaso previo a los principales conceptos lo que nos va a permitir comprender el resto de párrafos.
Toda la materia, entre la que incluimos el agua, el aire y por supuesto los seres vivos está compuesta de átomos. El átomo es la unidad más pequeña de materia que tiene las propiedades únicas de sus elementos. Un elemento es una materia compuesta por un solo tipo de átomo como por ejemplo el oxígeno o el nitrógeno. Los átomos a su vez se componen de otras partes más pequeñas: electrones, protones y neutrones. Lo que distingue a cada elemento es el número de protones encontrados en sus respectivos átomos.
Cuando los átomos se combinan forman estructuras más grandes que reciben el nombre de moléculas. Cada una de estas moléculas es exactamente igual a cualquier otra de esa misma sustancia. Los átomos de una molécula se sostienen por una asociación energética denominada enlace. Estos enlaces se clasifican por la dificultad que presentan para romperse. Esto hace posible entender porque ciertos compuestos se disuelven en agua y porque se disuelven en la manera que lo hacen. No vamos a profundizar más en los tipos de enlaces ya que el objetivo es describir en bruto la química del acuario.
|
Un tipo de enlace de los comentados anteriormente es el enlace iónico. Este tipo de enlace es el que se presenta en los ácidos y en las bases. Ambos se distinguen por su capacidad de tomar o perder un ión de hidrógeno. Los iones libres de hidrógeno se juntan a las moléculas de agua. Cuando medimos el Ph del agua estamos midiendo realmente la concentración de iones de hidrógeno presentes en el medio. La escala de Ph con la que trabajamos es una simplificación ya que realmente corresponde a los exponentes expresados en números absolutos. De esta forma un Ph neutro lo que entendemos como agua pura (7) equivale a una concentración de iones de hidrógeno de 10 a la –7. Lo que significa que 10 a la 7 gramos de agua contienen 1 gramo de iones de hidrógeno. |

|
Retomamos los términos ácido y base poniendo un ejemplo sencillo de entender. Cuando el amoniaco (NH3) que es una base acepta un ión de hidrógeno produce amonio (NH4) que es un ácido. En el caso contrario si este ácido suelta un ión de hidrógeno vuelve a convertirse en base. Al balance relativo entre las dos formas se describe como equilibrio constante. El Ph del agua puede influenciar la posición de equilibrio pero no del equilibrio constante en si. Por ejemplo un descenso de Ph por el incremento de iones de hidrógeno tiene como consecuencia una caída en el nivel de amoniaco y una subida en el nivel de amonio.
Los tampones
Un tampón se compone de dos partes, un ácido débil o base y una sal de ese ácido o base. El equilibrio constante de este ácido o base dictamina que Ph se mantendrá. Por ejemplo, un tampón basado en bicarbonato emplea un ácido débil (ácido carbónico) y una sal de ese ácido (bicarbonato sódico). Grandes cambios en la cantidad de ácido o base producen pequeñas alteraciones en el Ph final si el ácido y la base están en concentraciones iguales. Si excedemos un componente por encima de otro, en una determinada medida, el cambio de Ph será muy acentuado. Por tanto si la cantidad absoluta de los componentes es grande, su capacidad de tampón para resistir una variación de Ph será mayor también.
La ley de los gases
La presión del gas en el solvente (en nuestro caso el agua) determina su presencia. Si la presión aumenta también aumentará la concentración de gas disuelto. Otro de los factores que determina la presencia del gas en el solvente es la temperatura del medio. Si incrementamos la temperatura también se verá afectado el nivel de disolución disminuyéndose. A temperaturas elevadas los niveles de CO2 y oxígeno disuelto decrecen. Estos gases se encuentran presentes en el agua de forma inversamente proporcional uno del otro.
El CO2 y el Kh o dureza de carbonatos
El uso de un tampón de carbonato puede ser bastante engañoso debido a una peculiaridad que no se encuentra en otros sistemas tampón. Normalmente uno gana o pierde el componente ácido en un tampón con un cambio en el pH. Pero el tampón de carbonato puede también ganar o perder el componente ácido (ácido carbónico) con un cambio en la concentración de CO2. La concentración de CO2 se ve afectada por la temperatura, la aireación o la presión del CO2 en el gas por encima del agua.
Un decrecimiento en el nivel de CO2 en el agua producirá un descenso del ácido carbónico en el agua. La concentración de ácido carbónico disminuye para hacer al sistema volver a su equilibrio con el nuevo nivel bajo de CO2. Cuando el nivel de ácido carbónico cae, el nivel de bicarbonato sube también lo que nos produce un Ph superior. De la misma manera, un incremento en el CO2 resultará en un incremento en el ácido carbónico, seguido de un incremento en bicarbonato lo cual produce un descenso del Ph.
Alcalinidad y Kh
La alcalinidad se puede entender, en términos coloquiales, como la capacidad del agua para resistir el descenso de pH con la adición de un ácido. Cuanto más grande sea el número, más grande será la alcalinidad. La alcalinidad se puede dar por cualquier número de compuestos (carbonato, bicarbonato, borato, fosfato, hidróxido). Además, una medida de alcalinidad no necesariamente indica la presencia de cualquiera de estos compuestos arriba indicados.
La dureza de carbonatos o Kh es una mediad de la cantidad de carbonato / bicarbonato en un volumen de agua dado. También recibe el nombre de temporal porque varía en función de la concentración de CO2 y los niveles de ácido pueden afectar rápidamente este valor. Esto es en contraste con la GH (dureza general) que no cambia apreciablemente a corto plazo.
Para comprender completamente cómo el CO2 y el Kh funcionan en un acuario con plantas debemos por lo menos conocer levemente las cuestiones tratadas anteriormente. Los átomos forman la molécula de bicarbonato que se mantiene unida por lazos de fuerza. Cuando se añade agua, la molécula se disolverá formando aniones y cationes que establecerán un equilibrio entre las formas de cabonato, bicarbonato y ácido carbónico.
Cambios en cualquiera de ellos, Ph, CO2, bicarbonato o cabonato influenciarán la concentración de los otros tres. En un acuario plantado, el empleo de un sistema de inyección de CO2 apropiadamente instalado, el Kh y el Ph deberían permanecer estables porque solo se añade el CO2 necesario que las plantas necesitan. En la práctica esto es lo que se consigue cuando se usa un sistema de inyección de CO2 con un sistema de medición de Ph.
Aunque raramente se tienen problemas de Ph/Kh usando este sistema, todavía hay una ruta química por la cual el Kh y el ph pueden caer y que no se puede remediar por un sistema de CO2. Esta posibilidad existe porque los acuarios con plantas producen muchos compuestos orgánicos acidificantes (por ejemplo tánicos, húmicos, y ácidos úricos) que reaccionarán con el Kh (bicarbonato/carbonato) presente.
Esta reacción convierte el bicarbonato en ácido carbónico. El ácido carbónico produce CO2 que puede ser utilizado, ser expulsado en forma de gas o reequilibrarse. La llamada de alarma ante esta situación es la caída rápida del Ph que ocurre cuando la concentración de bicarbonato cae por debajo de la concentración de CO2. Una vez que esto ocurre es químicamente imposible restaurar este Kh perdido manteniendo o incrementando el nivel de inyección de CO2.
Sin embargo, esta pérdida drástica de Kh no es algo que ocurra comúnmente porque recurrimos a realizar un cambio de agua mucho antes de que esta situación pudiera suceder. Por eso es importante no descuidarse y obviar hacer cambios de agua durante varios meses.
La rapidez de este proceso está relacionada con la limpieza general del sistema. (por ejemplo, la eliminación efectiva de residuos) y el Kh inicial. En un acuario bien plantado sin inyección de CO2 las plantan usarán el CO2 disponible, causando que los carbonatos presentes reequilibren y produzcan por lo tanto más CO2. Los agentes acidificantes mencionados arriba tenderán a conducir el equilibrio de bicarbonato para producir más CO2.
En este tipo de ajuste, la presencia de agentes acidificantes puede tener un efecto beneficioso; ayuda a mantener un nivel de CO2 más alto que el que hubiera sido si la utilización hubiera sido la única fuerza conductora de la formación de CO2 adicional. Con este sistema uno debe mantener activamente el Kh añadiendo periódicamente solución tampón basada en bicarbonato. Las plantas están en esencia “comiendo” la solución tampón.
El uso de las plantas de CO2 y la presencia de agentes acidificantes en el agua conducen al equilibrio del bicarbonato para mantener un nivel constante de CO2. En la mayoría de los casos la cantidad de CO2 producido es adecuada para niveles de crecimiento de moderados a buenos, sin embargo, si las planta son capaces de consumir CO2 más rápidamente que lo que el reequilibramiento puede producir, entonces el paso de la reequilibración se convertirá en un factor limitante del crecimiento de las plantas (asumiendo que todos los demás nutrientes están en niveles suficientes para no limitar el crecimiento).
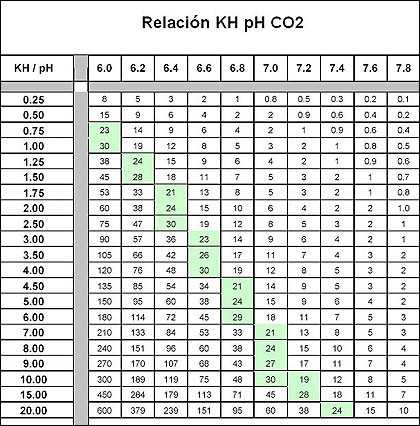
Cuadro de relación de cantidad de CO2 a aportar en función del Kh y el Ph.